Complexité de l’écosystème intestinal
D’assez nombreux chercheurs dans le monde étudient le rôle des acides aminés (molécules des protéines) pour améliorer les conditions du milieu digestif à mieux récupérer, mieux fonctionner. Dans cette étude chinoise, on a étudié le rôle d’hôte des muqueuses digestives et intestinales en particulier : c’est en effet sur ces muqueuses que se greffe dans la naissance un épais mucus dont le rôle sur la santé du microbiote sera crucial jusqu’à la fin de notre vie.
Le mucus est l’hôte principal des bactéries commensales. Rappelons que les bactéries commensales sont hérités à la naissance, puis enrichie durant les premières années de la vie grâce à l’allaitement, puis la diversification alimentaire. Elles sont passablement influencées par l’environnement de l’enfant, et par ses fréquentations puisque l’on sait aujourd’hui que le microbiote intestinal de l’enfant ne devient stable qu’après l’âge de 3 ans environ.
Rappelons également que le microbiote intestinal contient de nombreux autres micro-organismes : virus (notamment les célèbres bactériophages), levures et champignons, archées, parasites divers (nombreuses familles possibles, ce qui créé un véritable organe à part entière, d’une complexité inouïe, vivant normalement en « osmose » mais dont l’équilibre est fragile.
Le mucus, la muqueuses et son principal écosystème immunitaire : le GALT
Pour fonctionner ce microbiote dépend de nombreux facteurs, en particulier ceux en lien avec le mucus et ceux en lien avec la muqueuse.
Le mucus a une fonction de protection et d’hydratation de la muqueuse ; il contient notamment de l’eau, des protéines, des glucides et des lipides. La stabilité de la couche de mucus est assurée par des mucines dont MUC2, une protéine indispensable à son efficacité, composée de 80 % de sucres à longue chaîne appelés O-glycanes. Ceux-ci protègent la couche épithéliale, servent de point d’ancrage aux bactéries présentant des protéines membranaires d’adhésion et servent de nutriments pour les bactéries.
– La muqueuse intestinale forme des plis visibles et est tapissée d’une seule couche de cellules (entérocytes). Ces entérocytes s’agencent pour former environ 10 millions de villosités (de l’ordre de 1 mm) et présentent à leur surface apicale des microvillosités de 1 μM environ (environ 600 microvillosités par cellule). Cette structure particulière augmente considérablement la surface de contact entre l’intestin et les aliments. En effet la surface moyenne de l’intestin est de 250 m², soit un court de tennis. Ainsi, l’absorption est augmentée en efficacité sur une surface 5 fois supérieure à celle du corps entier !
– Le GALT (Gut-associated lymphoïd tissue ou tissu lymphoïde du tube digestif) est un tissu lymphoïde (sorte de « mini ganglions ») donc immunitaire associé à la muqueuse. Du fait d’une surface de contact avec l’extérieur importante et d’un nombre considérable d’échanges, ces cellules immunitaires reçoivent des informations venues de la lumière intestinale (composés alimentaires mais également microbiote) ainsi que des signaux émis par les cellules de la muqueuse. Ce dialogue est capable de déclencher une réponse immunitaire pour contrer l’invasion d’organismes étrangers pathogènes via l’intestin, ou au contraire de tolérer des éléments (comme les pollens par exemple) en évitant les réactions allergiques.
C’est la raison pour laquelle plus de 70 % des cellules immunitaires se situent dans l’intestin et forment le GALT. Le GALT est un système de défense spécifique et est composé de lymphocytes T et B, de plasmocytes et de macrophages. L’intestin est ainsi le siège d’une production importante d’anticorps. Il joue un rôle essentiel de défense local (tissulaire) mais a également un rôle de contrôle sur l’ensemble de l’immunité du corps.
Le fonctionnement intestinal est en lien particulièrement étroit aux systèmes nerveux, hormonal et immunitaire
C’est la constatation de plus en plus évidente que nous étudions en médecine fonctionnelle et en micro-nutrition. Le lien avec le système immunitaire est bien connu et documenté, et fait l’objet d’un nombre croissant d’études et de publications. En revanche son lien avec les systèmes hormonaux et nerveux est moins connu et moins étudié.
Pourtant c’est la constatation de nombreux praticiens et patients :
A- En améliorant le fonctionnement nerveux :
- meilleurs apports nutritionnels spécifiques des nerfs
- gestion du stress et de l’anxiété
- amélioration des pratiques sportives et exercices physiques
- amélioration de la qualité du sommeil
- amélioration des liens sociaux
- stimulation du nerf vague grâce à diverses actions (neurostimulateur ou ostéopathie du nerf vague ou exercices de stimulation empruntés aux neurosciences )
ont constate régulièrement de fortes améliorations des symptômes digestifs, plus ou moins durables en fonction des sujets.
B- En améliorant le fonctionnement des glandes endocrines, en constate également très souvent des améliorations déterminantes quant aux symptômes digestifs chroniques.
En particulier, nous avons observé des améliorations, en collaboration avec des médecins formés en médecine fonctionnelle et micro-nutritionnelles :
- en soutenant le fonctionnement thyroïdien (micro-nutritions et parfois extraits thyroïdiens ou médicaments de la thyroïde
- en soutenant le fonctionnement des glandes surrénales : soit avec des plantes adaptogènes soit des nutriments, soit en améliorant la qualité du sommeil ou la gestion du stress, afin d’améliorer la régulation du cortisol ou de l’adrénaline, notamment en soirée, soit en mesurant les taux sériques de la DHEA et de la prégnénolone, et en agissant le cas échéant par une supplémentation
- en agissant sur les dys-régulations des oestrogènes ou de la progestérone, ou encore sur la testostérone (en particulier la dihydro-testostérone) ou l’hyper-oestrogénie relative.
- en proposant une action de détox des perturbateurs endocriniens
Résumé de l’étude chinoise
Lien : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8110859/
Ces dernières années, de nombreuses études ont montré que la microflore intestinale a divers effets qui sont liés aux fonctions physiologiques critiques et aux systèmes pathologiques de l’hôte. La communauté microbienne intestinale est largement impliquée dans le métabolisme des composants alimentaires tels que les protéines, qui est l’un des nutriments essentiels dans l’alimentation. En outre, il a été démontré que les protéines/acides aminés alimentaires ont eu un impact profond sur le profil et le fonctionnement du microbiote intestinal. Cette revue résume la littérature actuelle sur l’interaction mutuelle entre le microbiote intestinal et le métabolisme des protéines/acides aminés pour l’immunité et la santé des muqueuses de l’hôte.
Mots clefs:
1. Introduction
Le tractus gastro-intestinal (GIT) abrite de grandes quantités de micro-organismes, qui jouent un rôle essentiel dans de nombreuses fonctions physiologiques critiques de l’hôte (Lin et al., 2017), y compris l’homéostasie métabolique et nutritionnelle, la maturation et la stimulation du système immunitaire, et l’activité cérébrale (Agus et al., 2018). Le microbiote intestinal joue un rôle important pour faciliter la digestion et l’absorption des protéines/acides aminés, en décomposant des sous-unités complexes et en modifiant les mécanismes métaboliques de la cellule hôte. Cela rend les nutriments facilement absorbables par l’hôte et modifie ensuite les mécanismes métaboliques de la cellule hôte (Armstrong et al., 2019; Ibrahim et Anishetty, 2012). De plus, les bactéries colonisant l’intestin ont la capacité de faciliter la synthèse de novo des acides aminés essentiels, qui sont impliqués dans l’homéostasie des acides aminés chez l’hôte (Collins et al., 2012).
Le profil du microbiote intestinal est influencé par de nombreux facteurs, y compris les facteurs basés sur l’hôte et les facteurs environnementaux. L’un des facteurs fondamentaux est le régime alimentaire d’accueil (Rist et al., 2013). Des études antérieures ont montré que la modération des protéines/acides aminés alimentaires est une approche stratégique pour le contrôle des espèces bactériennes fermentes d’acides aminés et de leurs voies métaboliques, qui à leur tour pourraient avoir un impact sur le métabolisme de l’hôte (Shen et al., 2010; Rist et al., 2013; Vital et al., 2014).
Le présent examen a pour objet de décrire l’interaction complexe entre le microbiote intestinal et les protéines/acides aminés alimentaires pour l’immunité et la santé des muqueuses hôtes.
2. Réglementation des microorganismes intestinaux sur le métabolisme et la synthèse des protéines/acides aminés
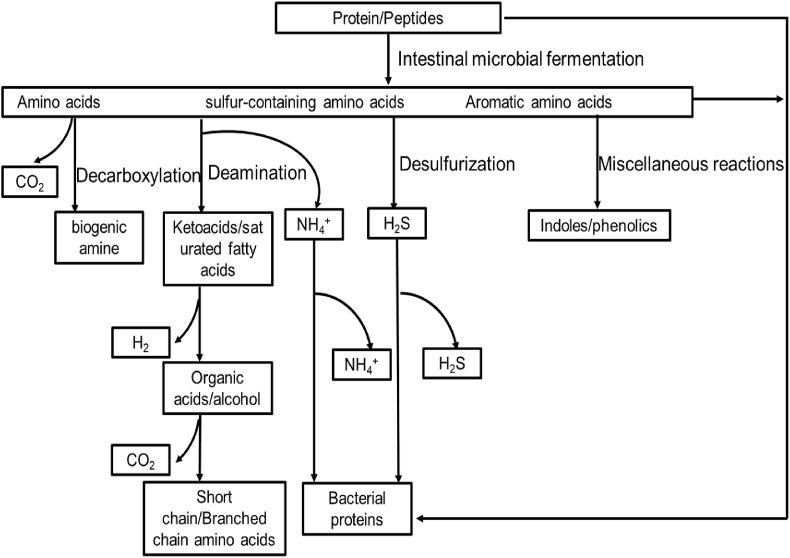
La flore intestinale régule diverses voies métaboliques chez l’hôte, y compris celles liées au métabolisme du glucose, des lipides et des lipides. Les métabolites bactériens de l’ITG sont extrêmement compliqués. De nombreux métabolites produits par la microflore intestinale utilisent des acides aminés comme substrats (Wikoff et al., 2009). Les acides aminés présents dans les aliments ou ceux synthétisés par l’hôte peuvent fournir une nutrition à la flore intestinale pour la synthèse protéique. Les acides aminés peuvent être directement incorporés dans les cellules bactériennes en tant que résidus d’acides aminés dans les protéines et entrent dans la voie catabolique. Les protéines sont hydrolysées en acides aminés et en peptides par des protéases et des peptidases extracellulaires sécrétées par des microorganismes intestinaux. En présence de transporteurs spécifiques, les acides aminés et les peptides peuvent pénétrer dans des cellules microbiennes (Gottschalk, 1979). Cependant, ces biomolécules peuvent rencontrer différents des destin en fonction des conditions physiologiques du corps qu’elles rencontrent (Fig. 1; Davila et consorts, 2013). La première étape du catabolisme des acides aminés est la transamination ou la désamination; les acides aminés subissent une oxydation, une réduction, ou les deux (rédox). L’ammoniac métabolique peut être utilisé soit comme source d’azote par les micro-organismes, soit excrété (Blachier et al., 2007). Les diaminases et les décarboxylases sont des enzymes impliquées dans le métabolisme des acides aminés. Les acides aminés sont métabolisés en amines biogéniques par une réaction de décarboxylation. Davila et al. (2013) décrivent de nombreux acides aminés complexes, tels que les acides aminés aromatiques qui sont résistants aux enzymes mentionnées ci-dessus, qui peuvent être métabolisés par une série de réactions telles que la fission, la désamination, la décarboxylation, l’oxydation et la réduction pour produire une variété d’indoles et de phénols structurellement apparentés.
Voie de catabolisme des protéines des microorganismes coliques. Les acides aminés produits par le métabolisme microbien peuvent être directement utilisés par les microorganismes pour synthétiser les protéines bactériennes, et peuvent également entrer dans la voie catabolique, qui est le principal mode métabolique des acides aminés dans le côlon. Dans le métabolisme microbien, la plupart des acides aminés produisent des acidémies ou des acides gras saturés correspondants par transamination ou désamination tels que les acides gras à chaîne courte, les acides organiques, l’éthanol, l’H 22 et le CO 22. Certains acides aminés sont métabolisés en amines biogéniques par décarboxylation. De nombreux acides aminés complexes, tels que les acides aminés aromatiques, ne se produisent pas seulement dans les réactions générales ci-dessus. Ils peuvent être métabolisés par une série de réactions telles que la fission, la désamination, la décarboxylation, l’oxydation et la réduction pour produire divers indoles et phénols.
Mafra et al. (2013) ont rapporté que les bactéries et les proponibacterium étaient les principales bactéries protéolytiques dans les échantillons fécaux; Clostridium, Streptococcus, Staphylococcus et Bacillus sont également des bactéries protéolytiques courantes. Les microorganismes coloniques décomposent les protéines et les peptides pour produire une variété de produits finaux, y compris les acides gras à chaîne courte (SCFA), l’ammoniac, les amines, les phénols, les indoles, les mercaptans, le dioxyde de carbone, l’hydrogène et le sulfure d’hydrogène, dont beaucoup sont toxiques (Mafra et al., 2013). La production de ces métabolites est généralement considérée comme un marqueur pour évaluer le niveau de fermentation protéique dans le côlon. En outre, il a été rapporté que la flore colique accélère le métabolisme des protéines non digérées et la teneur en métabolites bactériens, y compris les acides aminés, les phénols, les indoles, l’hydrogène sulfuré et les acides gras à chaîne ramifiée (isobutyrate, isovalerate et 2-méthylbutyrate), qui sont augmentés dans l’épithélium du côlon (Thom et Lean, 2017).
Les acides aminés produits ou métabolisés par les bactéries peuvent être utilisés par l’hôte, et ceux-ci peuvent compenser le manque d’acides aminés essentiels dans un régime protéique de mauvaise qualité. Une analyse à l’échelle du génome a montré que Clostridium perfringens manque d’un certain nombre de gènes pour la biosynthèse d’acides aminés tels que l’acide glutamique, l’arginine, l’histidine, la méthionine, la sérine, la thréonine ainsi Clostridiumque Clostridium acetobutylicumles acides aminés à chaîne aromatique et ramifiée (Portune et al., 2016),ynthèse (N-lling et al., 2001). Il est donc nécessaire de comprendre les voies de biosynthèse des acides aminés dans les microorganismes afin d’élucider les fonctions de différents acides aminés selon les espèces bactériennes. Le coût métabolique de la synthèse des acides aminés est aussi élevé que le squelette de carbone de tous les acides aminés provenant d’intermédiaires métaboliques courants, qui sont impliqués dans le cycle de l’acide tricarboxylique, la voie du phosphate de pentose et la glycolyse (Mu et al., 2015). Cependant, il a également été rapporté que les protéines alimentaires résiduelles qui atteignent le gros intestin peuvent fournir de l’azote et des acides aminés pour la croissance et la fermentation des bactéries glycolytiques (Mafra et al., 2013). L’acide gamma aminobutyrique est une substance neuroactive produite par plusieurs souches de Lactobacillus et Bifidobacterium (Barrett et al., 2012). Lactobacillus reuteri peut produire de l’histamine (Hemarajata et al., 2014), et les bactéries et les champignons produisent de l’acétylcholine. De plus, la tryptophane décarboxylase a également été détectée dans la flore intestinale humaine, indiquant que le tryptophane peut être produit par la flore intestinale ().
3. Effets du métabolisme des protéines et des acides aminés alimentaires sur les micro-organismes intestinaux
De nombreux facteurs régulent la composition et les fonctions physiologiques du microbiote; l’un des principaux facteurs qui conduit à un déséquilibre dans la composition du microbiote intestinal est l’alimentation (Moszak et al., 2020). Certains suggèrent que les variations des protéines alimentaires provoquent des changements dans la composition et la fonction de la flore intestinale (Wang et al., 2020). Un régime riche en protéines (HPD) a un effet important sur la composition de la microflore intestinale. Les bactéries productrices d’acide butyrique, qui sont estimées à 2 % à 15 % des bactéries totales, se trouvent chez les Lactobacillaceae (Clostridium XIVa). Dans une étude, l’abondance de ces bactéries a diminué de manière significative chez les volontaires humains ayant reçu une DHP, et leur abondance était significativement corrélée aux taux d’acide butyrique fécaux (Duncan et al., 2007). Il a été rapporté qu’une augmentation de l’apport de protéines alimentaires diminue la diversité microbienne fécale chez la plupart des souris, mais pour augmenter la diversité microbienne du lait microbien et le cecum, et augmente également le nombre de bactéries potentiellement favorables à la santé, telles que Lactobacillus spp. (Warren et al., 2019). Un régime riche en protéines a modifié la composition du microbiote intestinal à mesure que l’abondance de bactéries bénéfiques (telles que Bifidobacterium ou Rothia) a diminué (Salonen et al., 2014). Dans une étude de Mu et al. (2017), des rats adultes ont reçu un régime alimentaire régulier en protéines ou une HPD pendant six semaines, et leurs fèces ont été collectées à intervalles hebdomadaires et analysées pour leur composition microbiologique. Par rapport aux échantillons fécaux de rats qui ont reçu un régime régulier de protéines, les échantillons fécaux de ceux nourris avec une DHP ont eu un nombre accru d’Escherichia coli mais ont diminué le nombre d’Akermania mucilaginosa, Bifidobacterium, Prevotella et Brucella. De plus, les personnes nourries à une DHP présentaient des concentrations réduites d’acétate, de propionate et de butyrate dans leurs excréments. Dans des études précédentes, il a été rapporté qu’une DPH augmentait le nombre d’espèces de Clostridium dans le côlon des porcelets et le nombre , de Shigella et de Streptococcus, et de réduction du nombre de ruènes cocci, de bactéries d’Ackermann et de Faecalbacterium prausnitzii dans le côlon de rats, mais réduisaient le nombre de Rose sac/Eucbacterium.
En outre, la restriction des protéines ou des acides aminés et la supplémentation en acides aminés ont également modifié la composition du microbiote intestinal. Wang et consorts. (2019) a rapporté que les régimes hypoprotéiques à faible teneur en protéines avec hydrolysat de la caséine réduisaient les concentrations de putrescine, de phénol et d’indole dans la digesta colique des porcs et l’abondance relative de L. reuteri dans le côlon des porcs au niveau de l’espèce, par rapport aux régimes ajoutés avec des acides aminés libres. La restriction lysine a renforcé les abondances relatives d’Actinobacteria, de Saccharibacteria et de Synergistetes dans l’iléon des porcelets au niveau du phylum et des moraxellaacee, des halomonadaceae, des shewanellaceae, des Corynebacteriaceae, des bacillaceaeCaulobacteraceae, Synergistaceaedes comamonadaae Microbacteriaceae.2017). Yin et al. (2018) a constaté que la restriction alimentaire de la lysine augmentait l’abondance relative d’Escherichia-Shigella, d’Aquabacterium et de Candidatus Méthylomirabilis dans l’iléon des porcelets au niveau du genre, tout en réduisant l’abondance de Streptococcus, Bacteroides, Bacillus, Pasteurella, Clostridium sensu stricto, FaecalibacterPaucisalibacillusLachnoclostridium. Un régime pauvre en protéines a diminué la richesse relative de Firmicutes dans le contenu du côlon des porcelets sevrés au niveau du phylum, tout en augmentant la richesse relative des protéobactéries (Wan et al., 2020). Dans une étude de Raza et al. (2020), lorsque les mouches traitées par antibiotiques ont été exposées à des conditions de 10 oC, les mitochondries de leurs cellules intestinales ont été gravement endommagées; l’administration de l -arginine et l -proline par micro-injection a considérablement prolongé la durée de survie des mèches traitées par antibiotiques. Ces résultats indiquent que la microflore intestinale joue un rôle vital dans la promotion de la résistance chez l’hôte contre le stress induit par les basses températures via la stimulation des voies métaboliques de l’arginine et de la proline.
4. Immunorégulation des métabolites protéiques/acides aminés sur la muqueuse intestinale
La fonction de l’intestin est compliquée en ce sens qu’il peut permettre sélectivement aux nutriments de passer et d’entrer dans le système circulatoire et l’environnement interne de l’organisme; d’autre part, il peut empêcher l’invasion de toxines, d’agents pathogènes et de facteurs inflammatoires (Song et al., 2010). Cette dernière fonction est également connue sous le nom de fonction de barrière de la muqueuse intestinale (K-nig et al., 2016). La barrière des muqueuses intestinales est la première barrière de l’organisme contre l’environnement extérieur. Une barrière de la muqueuse intestinale saine est importante pour assurer une nutrition adéquate et prévenir les maladies intestinales associées (Yang et al., 2017).
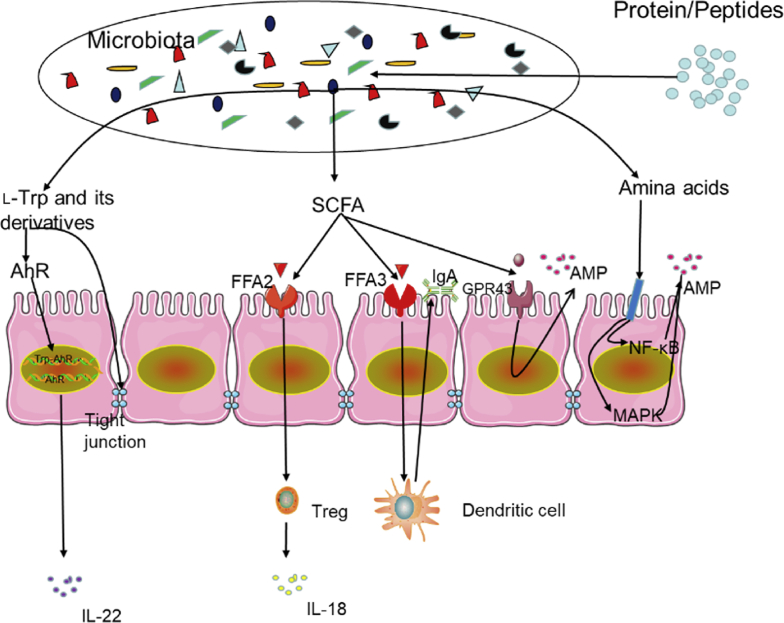
Des études antérieures ont également révélé que les métabolites bactériens tels que les SCFA et les ligands des récepteurs hydrocarbonés aryl (AHR) sont bénéfiques pour le système immunitaire intestinal (Fig. 2) L’acide butyrique régule l’immunité et l’inflammation tissulaire en contrôlant les cellules épithéliales intestinales (IEC), en favorisant le développement des cellules T régulatrices, en améliorant la sécrétion de mucus par les cellules de gobelet et en favorisant le flux de l’IL-18 dans les cellules T (Goldsmith et Sartor, 2014; Koh et Bockhed, 2020). Les récepteurs 2 exempts d’acides gras (FFA2) et FFA3, qui sont des récepteurs couplés aux protéines G, intermédiairent en partie les effets extracellulaires de l’ACSF. Les récepteurs-2 et FFA3 exempts d’acides gras sont des régulateurs essentiels de l’inflammation intestinale et de la fonction barrière épithéliale. Le récepteur 2 en acides gras libres régule le développement de cellules T régulatrices; en outre, l’impact de la FFA2 sur les cellules dendritiques peut favoriser la production d’IgA intestinale, qui offre une protection supplémentaire pour la CEI contre les micro-organismes pathogènes (Holota et al., 2019). La différence par rapport à la FFA2, FFA3 (qui est exprimée dans les cellules non-immunes intestinales) augmente l’expression de la transformation du facteur de croissance-z, de l’IL-6 et d’autres cytokines et chimiocines principalement par la voie de la protéine kinase activée par le mitogène/axé sous signal extracellulaire (Kim et al., 2013). Les dérivés d’indoles tels que l’indole-3-aldéhyde, l’acide indole-3-acide-acétique, l’acide indole-3-propanoique, l’indole-3-acétaldéhyde et l’acide inoléique jouent un rôle essentiel dans l’homéostasie intestinale en participant au renouveau de l’IEC, à l’intégrité barrière et à de nombreux types différents de différenciation des cellules immunitaires ().
Effet immunomodulateur des métabolites protéines/acides aminés sur le côlon. Le tryptophane favorise l’expression de la protéine de jonction serrée pour atteindre la fonction barrière intestinale. Le récepteur d’Aryl hydrocarbone (AHR), qui est un régulateur de transcription ligand-dépendant dans le cytoplasme, peut se lier au tryptophane et à ses métabolites en aval. Le complexe résultant est transporté jusqu’au noyau, où l’AHR est activé. Cela régule la prolifération et la différenciation des cellules inflammatoires intestinales ainsi que la transcription et l’expression de facteurs inflammatoires (tels que l’interleukine-22, l’IL-22). Les acides gras à chaîne courte régulent l’immunité protectrice et l’inflammation tissulaire en contrôlant les cellules épithéliales intestinales (IEC), en favorisant le développement des cellules T régulatrices (Treg), en améliorant la sécrétion de mucus par les cellules de goupille et en favorisant l’IL-18 dans les cellules T. Les récepteurs 2 et 3 des acides gras à chaîne courte (FFA2 et FFA3) sont des régulateurs essentiels de l’inflammation intestinale et de la fonction barrière épithéliale. Le récepteur 2 des acides gras à chaîne courte régule le développement de Treg. Le récepteur 2 des acides gras à chaîne courte sur les cellules dendritiques peut également favoriser la production d’IgA intestinale. La différence de la FFA2, FFA3 (qui est exprimée dans la population de cellules non-immunes intestinales) augmente l’expression de la transformation du facteur de croissance, de l’IL-6 et d’autres cytokines et chimiocines principalement par la voie des protéines activées par le mitogène (MAPK)/axées de la marque; les acides gras à chaîne courte peuvent promouvoir la CEI pour produire des peptides antimicrobiens (AMP) par FFA2. Certains acides aminés stimulent significativement l’expression de la «-défense dans les cellules épithéliales en bloquant le facteur nucléaire kappa-B) et les voies de signalisation inflammatoires MAPK et en activant la cible de mammifères de la voie de signalisation de la rapamycine.
lL’hyptophane, qui est utilisé dans l’enrichissement nutritionnel des aliments, joue un rôle vital dans le maintien de l’équilibre entre la tolérance immunitaire intestinale et le maintien du microbiote intestinal. Des résultats récents ont mis en évidence les changements dans le microbiome qui régulent le système immunitaire de l’hôte en réglorant le métabolisme du tryptophane. De plus, il a été rapporté que le tryptophane, les métabolites endogènes du tryptophane et les métabolites bactériens du tryptophane présentent des effets profonds sur l’interaction du microbiote intestinal du système immunitaire de l’hôte (Gao et al., 2018). Une étude a montré que l -tryptophan a amélioré l’expression de la protéine de jonction serrée dans la CEI de porc in vitro (Wang et al., 2015). De plus, il a été rapporté que l -tryptophane augmente la résistance des cellules épithéliales aux jonctions serrées. Le propionate d’indole, qui est un autre métabolite bactérien du tryptophane, peut réduire efficacement la perméabilité intestinale chez les rongeurs (Dodd et al., 2017). Des études récentes ont montré que le tryptophane pourrait améliorer la fonction de barrière intestinale en favorisant l’expression de la zonula occludens 1 (Dodd et al., 2017). Les dérivés du tryptophane tels que l’acide indoleacétique et l’acide indole-3-propionique sont produits par Streptococcus et Clostridium sporogenes, respectivement, et régulent la fonction barrière intestinale via le récepteur exogène de la prégnanique X (Elias et al., 2014). Des études ont montré que le tryptophane et ses métabolites en aval peuvent se lier à la RSA; le complexe résultant est transporté dans le noyau, où la procréation assistée est activée, ce qui régule l’inflammation intestinale, la prolifération et la différenciation cellulaires, ainsi que la transcription et l’expression de facteurs liés à l’inflammation (Lanis et al., 2017).
Les peptides antimicrobiens (AMP) produits par la CEI jouent un rôle crucial dans la régulation de l’homéostasie intestinale en contrôlant les populations microbiennes. La supplémentation en acides aminés alimentaires pourrait améliorer l’expression intestinale de l’AMP, maintenir l’homéostasie des microorganismes intestinaux et réduire la sensibilité à l’inflammation intestinale (Hashimoto et al., 2012). En tant qu’acide aminé essentiel traditionnel chez les mammifères matures, l’arginine est utilisée dans la synthèse de protéines et de nombreuses molécules bioactives. L -l -rginine atténue la réponse inflammatoire et les lésions intestinales en bloquant l’activation du facteur nucléaire kappa-B et les voies de signalisation inflammatoire de la protéine kinase activées par mitogène, stimulant significativement l’expression de la bêta-défense dans les cellules épithéliales. Le butyrate peut favoriser la production d’AMP, tel que la protéine III- et la défensine dérivée de l’îlot régénératif, chez la CEI de souris à travers le récepteur SCFA (récepteur à couple de protéine G 43) (Chen et al., 2020). Le butyrate augmente également de manière significative l’expression de la »-défensin-2 et de la z-defensin-3 (zeng et al., 2013).
5. Protécédés/métabolites d’acides aminés dans la progression des maladies gastro-intestinales
La réponse innée de l’hôte au microbiote joue un rôle essentiel dans l’homéostasie de l’immunité intestinale et de la pathogenèse inflammatoire des maladies de l’intestin (MII). Cependant, dans la plupart des systèmes de modèles, les défauts de la voie intrinsèque ne provoquent pas la destruction de l’homéostasie et le développement de la DCI (Elson et Cong, 2012). L’interaction entre l’hôte et sa riche microflore intestinale est complexe; certains symbiotes, tels que les myxomycètes et Helicobacter spp., sont généralement appelés organismes pathologiques car ils peuvent provoquer des maladies dans certaines conditions. La composition du microbiote intestinal présente un large éventail de variabilités inter- et intra-individuelles (Huttenhower et al., 2012), qui est considérée comme un déterminant clé de la susceptibilité de l’hôte à diverses maladies, dont la MICI (Caruso et al., 2020).
Une fermentation excessive de protéines produit des métabolites tels que les amines, le sulfure d’hydrogène, le p-crésol et l’ammoniac, qui peuvent endommager l’épithélium du côlon (Arumugam et al., 2011). Certains de ces produits peuvent induire des lésions de l’ADN, des fuites intestinales, le cancer du côlon, la MICI et d’autres maladies (Marchesi et al., 2016). Les progrès récents du séquençage à haut débit ont lié le déséquilibre de la communauté microbienne causé par la HPD à de nombreuses maladies gastro-intestinales. Liu et consorts (2014) a constaté que bien que la HPD ait modifié la composition de la microflore intestinale et augmenté le taux d’utilisation des substrats, l’augmentation de la teneur en volume protéique dans le gros intestin n’affectait pas la concentration de butyrate, maintenant ainsi l’homéostassis métabolique de l’épithélium du côlon. Cependant, la HPD a montré une réduction de la concentration de butyrate fécale de manière répétitive. La prise de régimes riches en graisses et en protéines peut entraîner un dysfonctionnement du microbiote intestinal; sa biosynthèse peut entraîner un déséquilibre, qui provoque par la suite une inflammation intestinale qui peut conduire davantage à une MICI (Shi et al., 2020). La protéine 9 contenant un domaine de recrutement de Caspase est l’un des nombreux gènes sensibles aux MICI, favorisant la récupération de la colite en activant la voie interleukine-22 (Lamas et al., 2016). Récemment, il a été constaté que les déficiences du microbiote de la protéine 9 contenant du domaine de recrutement de caspases chez la souris entraînaient des niveaux réduits de bactéries avec le catabolisme tryptophane, qui réglementait la production d’interleukine locale-22 et affectaient l’équilibre entre le microbiote et les cellules hôtes (Behnsen et al., 2014; zenwicz et al., 2013).
L’axe du cerveau gastro-intestinal est un réseau de communication bidirectionnelle entre le GIT et le système nerveux central. Des études menées au cours des 30 dernières années ont décrit le rôle de l’interaction cerveau-intestin dans les maladies gastro-intestinales fonctionnelles telles que le syndrome du côlon irritable (SCI) (Mayer et al., 2006). Ces dernières années, la microflore intestinale a été considérée comme un médiateur critique de la signalisation des axes intestinales (Cryan et Dinan, 2012), qui joue un rôle important dans de nombreux aspects de la fonction et du comportement du cerveau (Sampson et Mazmanian, 2015). Le tryptophane et d’autres acides aminés sont des neurotransmetteurs du système nerveux central. Le tryptophane peut également être métabolisé en kynurénine et indole, ce qui entraîne la régulation des réponses immunitaires neuroendocrines et intestinales (Gao et al., 2020). Après la métabolisation du tryptophane en kynurénine, il est encore métabolisé par deux voies différentes: les voies de l’acide kynurénique et de l’acide quinolinique. Les métabolites produits par la voie de l’acide kynurénique sont appelés « kynurénine » (Luki et al., 2019), qui peuvent avoir des propriétés anti-inflammatoires dans le GIT et participer à la régulation immunitaire (Kennedy et al., 2017). C’est également un métabolite neuroactif qui inhibe les drécepteurs N-méthyl-d-aspartate et z7 nicotiniques acétylcholine, qui peuvent traverser la barrière hémato-cerbulle et atteindre le système nerveux central. La dysrégulation de la 5-hydroxytryptamine a été observée dans des maladies gastro-intestinales telles que les MICI (Gracie et al., 2019) et le SII, qui sont des maladies gastro-intestinales fonctionnelles accompagnées de complications psychiatriques graves et de troubles du spectre autistique. Une étude récente de souris BTBR T et tf/J (BTBR), utilisant un modèle de comportement de type défaut septal auriculaire, a montré des dommages liés au microbiote causés par la production de 5-hydroxytryptamine intestinale (Golubeva et al., 2017). L’anomalie septale auriculaire est généralement associée à des symptômes gastro-intestinaux et peut donc être liée à des troubles du métabolisme du tryptophane dans l’intestin (Gheorghe et al., 2019). Ils sont donc considérés comme des neuromodulateurs dans divers processus physiologiques et pathologiques du cerveau et des dysfonctionnements gastro-intestinaux (Gao et al., 2020).
6. Conclusions
Les microbes intestinaux peuvent établir une relation mutuelle avec l’hôte en facilitant l’évolution de la digestion et de l’absorption des protéines/acides aminés. Les acides aminés, soit à partir du régime alimentaire, soit produits par l’hôte, peuvent fournir une nutrition pour la flore intestinale et soutenir la synthèse des protéines. Cette interaction mutuelle se traduit par le maintien de la composition et des fonctions physiologiques des communautés microbiennes et de l’homéostasie de la réponse immunitaire intestinale de l’hôte. Un déséquilibre dans la composition de la microflore intestinale est l’une des causes de diverses maladies gastro-intestinales. Un déséquilibre dans l’ingestion de protéines/acides aminés conduit à un déséquilibre dans la composition de la flore intestinale, qui peut conduire à une MICI, à un SII ou à d’autres maladies gastro-intestinales. En conclusion, une compréhension plus complète du croisement entre le microbiote intestinal et l’hôte par le biais de l’élucidation du métabolisme des protéines/acides aminés est essentielle au développement de nouvelles interventions thérapeutiques.
Contributions d’auteur
Liuting Wu et zhihong Sun rédigent le manuscrit. Huiyuan Chen, Jongxiang Ren, Qi Ding et Kaiyang Liang ont passé en revue le manuscrit. Il a conceptualisé l’étude et reliait le manuscrit.
Conflit d’intérêts
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêts.
Remerciements
Cette étude a été financée par des subventions de la National Natural Science Foundation (Chine) (31872370); Fonds de recherche fondamentale pour les universités centrales, Chine (XDJK2019B014); Projet de la Fondation pour les sciences naturelles du CQ
J’oubliais de préciser je prends également des granulés d’isothérapie de selles
Du desmodium et du gel d’aloe après les repas.
Je fais du yoga, un peu de vélo et de marche et de méditation.
Je ne sais plus quoi faire pour guérir et surmonter ma fatigue.
Merci pour votre aide
Merci pour votre mot !
En effet les disciplines scientifique occidentales peinent à approfondir les causes de nombreux symptômes et également la réalité de l’architecture énergétique du corps ou encore des émotions enfouies à l’intérieur de nous et qui peuvent bien entendu être dysfonctionnels.
Remonter la pente est parfois long mais c’est surtout pour beaucoup d’entre nous un manque de recherches. Je pense qu’au moins une solutions existe pour chaque être humain.
Je vais vous donner 3 exemples différents.
Exemple 1
j’ai un cousin qui soufrait depuis 8 ans de fatigue extrême. Il a bien sûr consulté des tas de médecins et spécialistes.
L’an dernier je lui est envoyé quelques publications scientifiques sur l’intérêt et les avancées de la médecine psychédélique. Il a été fort surpris de l’existence de ces thérapies et a visionné les 3 reportages sur Netflix qui expliquent de manière remarquable ces nouvelles approches (voyage au confin de l’esprit). A force de chercher il a finit par tomber sur une équipe spécialisée (associée à un psychiatre spécialiste) aux Pays Bas et s’est inscrit en se disant qu’il ne risquait pas grand chose d’essayer.
Aujourd’hui après avoir vécu 3 expériences de psychédéliques (via un psychiatre néerlandais, et suivi d’une psychothérpaie émotionnelle qui l’ont transformé) il se dit nettement amélioré dans sa fatigie chronique, et par dessus le marché il se dit bien moins anxieux.
Il faut dire qu’il a eu une enfance difficile et qu’il n’avait pas vraiment pris conscience qu’il souffrait d’un stress post traumatique.
Donc dans son cas c’est bel et bien l’ignorance de l’existence la médecine psychédélique qui empêchait sa guérison
Bien sûr qu’il existe de très nombreuses autres approches, quasiment une infinité même, et qu’il ne faut hésiter à chercher
Exemple 2
Un de mes clients /patients dort beaucoup mieux depuis qu’il prend de la DAO (dyamine oxydase) au coucher (ça permet d’aider le corps a bien mieux dégrader l’histamine).
Il a donc compris que son corps dégradait mal l’histamine et qu’il fallait agir sur ce paramètre important.
Il a ensuite expérimenté 3 ou 4 séances de la méthode ByeBye allergies (ou la méthode LEAA je ne sais plus mais c’est quasiment la même chose) ce qui a permis de déprogrammer une partie de son histamine, et là il va encore mieux ! et aussi il a moins besoin de prendre de la DAO
Exmple 3
Une autre patiente a pris conscience qu’il avait mangé vraiment beaucoup de blé moderne dans sa vie et surtout qu’elle mangeait très très vite. J’ai donc supposé qu’elle souffrait de biofilms résistants dans ses 2 intestins. Or certains biofilsm ressemblent plus à des filaments de caoutchouc qu’à autre chose ! ()
On a donc décidé de prendre le taureau par les cornes et d’essayer ZENCLEANZ ONE un nouveau produit mais très innovant (beaucoup de témoignages) permettant de « décoller » les filaments de caoutchouc et les adhérences des parois intestinales. Elle est quasiment métamorphosée! Beaucoup moins de fatigue et un meilleur sommeil, le ventre beaucoup plus plat, moins de troubles digestifs variés….
Témoignage pour les anglophones :
Bonjour Monsieur,
Je lis avec grande attention vos articles que j’apprécie beaucoup. Je ne peux malheureusement pas vous consulter car j’habite Toulouse…..
Souffrant d’un SIBO, je suis très intéressée par le produit Zencleanz One, mais ayant des revenus très limités, cela semble un peu irréel. Je me suis rendue sur le site, et le produit est à 440 dollars, sans les frais d’expédition de DHL depuis Taïwan. Savez-vous ce qui justifie un tel tarif ? En regardant la composition, on remarque qu’il y a certes beaucoup de choses (essentiellement des fruits et des légumes), mais pas de produits d’exception.
Merci d’avance pour votre réponse
Bonjour
oui en effet ZENCLEANZ est un produit d’exception mais je pense que la réelle composition n’est pas détaillée sur le site, les enzymes permettant de nettoyer en profondeur les 2 intestins étant issus en effets de fruits et légumes. Ce qui certain c’est que 100% des personnes qui l’ont esssayé sont très impressionnées par les améliorations, et parfois même je reçois des photos de bouts de caoutchoucs qui sont sortis dans les toilettes !
Pour ma part au cabinet il m’arrive de citer ce produit mais je recommande au préalable un autre complexe d’enzymes protéolytiques bien plus abordable (comme Serracor-NK par exemple ou bien Candidase haute efficacité du labo Enzymedica sur le distributeur Iherb.com qui également 100% valable pour le SIBO)
Les amélioratins sont souvent suffisantes, surtout dans le profil suivant : personnes ayant longtemps mangé particulièrement beaucoup de blé moderne (le blé à 43 chromosomes créé en 2009) et de produits transformés /industriels ET qui ont mangé particulièrement vite.