Le SIBO c’est quoi ? pourquoi ça défraie la chronique
Depuis quelques années (depuis 2015 environ selon moi) on parle de plus en plus du SIBO (prolifération, ou pullulation bactérienne de l’intestin grêle) puisqu’un nombre grandissant de jeunes personnes, notamment les femmes, se plaignent de troubles digestifs et intestinaux persistants, en particulier de ballonnements et gonflements du ventre dès la fin du repas. Les gastro-entérologues s’interrogent et peinent à apporter des solutions efficaces, mais outre-atlantiques, ils parlent de plus en plus de ce phénomène relativement récent et un nombre négligeable de publications dans des revues de gastro-entérologie sont déjà disponibles.
Il semble, selon une évaluation citée dans une des toutes premières études américaines, qu’environ 84% des personnes souffrant de l’intestin irritable, souffriraient en réalité du SIBO. En réalité les choses sont complexes et les symptômes des deux affections sont globalement très proches et convergents.
En pratique ce sont surtout les praticiens formés en approches naturelles qui se spécialisent dans l’intestin irritable, le SIBO, la candidose et le reflux (naturopathes, praticiens en micro-nutrition et en thérapeutique traditionnelle chinoise, etc..). Mais de nombreux médecins sont amenés à se pencher sur la question, tellement la patientèle est en demande de réponse et de solutions.
Pour ma part j’ai eu la chance d’être formé par le Dr Bruno Donatini, gastro-entérologue avangardiste et singulier dès 2012 (sans toutefois suivre sa formation complète). Il est considéré comme ayant été précurseur en France sur ses investigations sur le SIBO. Son approche se démarque des approches américaines et australiennes, ce qui a contribué à ce qu’il soit finalement relativement peu suivi par les médecins et naturopathes francophones.
Aux USA ce sont avant tout le Dr Alisson Siebecker et le professeur Mark Pimentel qui ont été les pionniers de la vulgarisation de la notion de SIBO, de ses principales causes et des différents traitements. Et également quoi faire en cas d’échec. Depuis l’eau à couler sous les ponts et de nombreux praticiens dans le monde trouvent de nouvelles approches et de nouveaux protocoles toujours plus efficaces et durables, et surtout de plus en plus individualisés. Cette dernière notion est capital puisque le SIBO et autres affections digestives persistantes sont très lié aux notions d’histamine, d’intolérance à l’histamine et même parfois d’affections histaminiques et allergiques plus graves comme la mastocytose et le SAMA (syndrome d’activation mastocytaire).
Chercher les causes environnementales du SIBO ?
Mais c’est grâce à lui que j’ai pu me spécialiser en santé digestive et je reçois en cabinet depuis 2014, ce qui m’a permis de rencontrer plus de 3500 personnes souffrant de troubles digestifs. Cela m’a permis d’accumuler une solide expérience pratique, et c’est ainsi que j’ai pu me concentrer sur la recherche des causes du SIBO, dont la principale caractéristique est un dysfonctionnement de la motilité intestinale et de la « vitalité digestive » pourrait on rajouter. Parallèlement je me suis formé auprès de nombreux autres médecins et chercheurs avangardistes, ce qui m’a permis de mettre graduellement au point ce que j’appelle l’approche des trois piliers. Les trois piliers sensés regrouper la totalité des causes, notamment des causes environnementales, du SIBO (mais également d’autres affections reliés à l’intestin irritable comme les candidoses, parasitoses, le reflux gastrique, la fatigue chronique, le sommeil non réparateur, etc…).
Etude allemande très complète publiée en 2020 dans Coreus :
SIBO : examen complet des méthodes de diagnostique, de prévention et de traitement
Lien : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7386065/
Résumé
La prolifération bactérienne mineure intestinale (SIBO) est un trouble gastro-intestinal fréquemment diagnostiqué qui touche des millions de personnes dans tout le territoire des États-Unis. Il se réfère à une condition dans laquelle il y a un excès et un déséquilibre de petites bactéries intestinales. Malgré sa prévalence, il reste sous-diagnostiqué en raison de la nature invasive des tests de diagnostic. Les symptômes observés dans le SIBO, y compris la distension abdominale, les ballonnements, la diarrhée et la formation de gaz, ne sont pas spécifiques et peuvent se chevaucher avec d’autres troubles gastro-intestinaux. Les facteurs de prédisposition fréquemment cités incluent la suppression de l’acide gastrique, la dysmotilité, le pontage gastrique et les opiacés. L’étalon-or diagnostique reste l’aspiration et la culture de l’estomac des intestins. Cependant, en raison de sa nature invasive, il reste une méthode impopulaire chez les patients comme chez les cliniciens. Les tests respiratoires de glucose et de la lactulose sont devenus la méthode de diagnostic en pratique clinique en raison de sa nature non invasive et de son faible coût. Le traitement est orienté vers l’éradication des bactéries dans l’intestin grêle et consiste généralement en un traitement prolongé d’antibiotiques oraux. En raison des progrès récents dans notre compréhension du microbiome humain, nous sommes certainement prêts à une transformation de notre approche du diagnostic et du traitement de cette maladie.
Introduction et historique
La faible croissance bactérienne intestinale (SIBO) est une cause bien reconnue de maldigestion et de malabsorption dans le monde entier. Historiquement, SIBO a été largement considéré comme un diagnostic controversé et contesté. Cependant, il a récemment gagné en traction en tant qu’explication viable pour une grande variété de manifestations gastro-intestinales. Une grande partie de la controverse entourant le diagnostic provient de la vaste présentation clinique et du chevauchement substantiel avec d’autres diagnostics hétérogènes, le syndrome du côlon irritable (SCI) étant l’exemple le plus cité. L’ambiguité qui entoure SIBO est aggravée par l’absence de consensus lorsqu’il s’agit de diagnostiquer et de traiter la maladie. Cependant, beaucoup de choses ont récemment changé dans notre compréhension du SIBO et de la manière d’aborder le traitement. Les aspirats juédins précédemment utilisés et les analyses de fluides duodénales ont été remplacées par des tests respiratoires, tandis que les nouvelles directives publiées donnent une image plus claire de la manière d’interpréter les données de diagnostic, telles que les tests respiratoires. Dans cet examen complet, nous fournirons un examen actuel et à jour de la croissance bactérienne intestinale des petites croissances bactériennes, y compris la prévalence, la symptomatologie, la prédisposation des facteurs de risque, l’évolution des tests de diagnostic et les dernières options de traitement disponibles tout en se concentrant sur leur interface avec le régime alimentaire et la nutrition.
Examen
Microbiome humain normal
La meilleure compréhension du petit microbiome intestinal s’est avérée être la clé pour démêler SIBO, car il aide les cliniciens à déterminer la validité de toute méthode de diagnostic utilisée pour dépister cette maladie. La compréhension actuelle du microbiome humain a progressé rapidement au cours des dernières années. Cependant, on peut dire que nous sommes encore aux stades de la petite enfance, car il faut en savoir plus sur le microbiome en dehors du côlon. Historiquement, la plupart des études humaines du microbiome intestinal ont été basées sur des études fécales qui fournissent des informations précieuses sur le microbiome du gros intestin, mais elles ne répondent pas aux questions clés concernant les bactéries qui habitent l’intestin grêle.
L’intestin humain est habité par 10 14 cellules bactériennes, soit environ 10 fois plus que le nombre de cellules dans le corps humain. Ce microbiome diversifié est composé d’un large éventail d’organismes, y compris les bactéries, les champignons et les virus. Les bactéries compromettent la plus grande partie de ce microbiome, avec environ 500 à 1 000 espèces bactériennes différentes identifiées à ce jour2. Le nombre de bactéries augmente avec la progression de l’intestin grêle proximal vers le gros intestin. L’intestin grêle est composé principalement de bactéries à Gram-positive et aérobie, tandis que le gros intestin contient principalement des bactéries gram-négatives et anaérobies. Les principaux phyla comprenant l’intestin comprennent les Bacteroidetes et les Firmicutes, tandis que les Actinobacteria, les Fusobacteria, les Verrucomicrobia et les Cyanobactéries sont également présents, bien que dans une plus petite proportion [3-.
Pour les organismes connus, la culture reste la méthode de détection la plus sensible, permettant la classification de l’isolat basé sur la résistance aux antibiotiques, les mécanismes de résistance aux antibiotiques et la pathogénicité. Cependant, cette méthode convient particulièrement bien pour la détection d’un petit nombre d’organismes aérobies bien connus et ne permet pas la reconnaissance du grand microbiome intestinal anaérobie complexe. Au cours des quatre dernières années, l’analyse du microbiome intestinal est devenue plus pratique en raison des progrès remarquables des technologies de séquençage de la prochaine génération (NGS), qui permettent aux chercheurs d’analyser de manière exhaustive l’ensemble des structures de la communauté des microbiomes humains, y compris les microbes difficiles à cultiver4.
Facteurs de risque
La prévalence du SIBO dans la population générale n’est pas connue. Cependant, dans la plupart des études, le SIBO a été détecté entre 0 et 20 % des contrôles sains [5. Les facteurs de risque les plus fréquents de prolifération bactérienne anormale ou excessive de l’intestin de la intestinal incluent des troubles de l’anatomie et de la motilité dans l’intestin grêle. Des exemples fréquemment cités incluent l’entériopathie diabétique, la maladie du tissu conjonctif sous-jacente, l’utilisation chronique d’opiacés, les diverticules, les adhérences de l’intestin de petite taille et les membres aveugles. De plus, les troubles de la clairance biochimique normale des bactéries prédisposent également à la prolifération bactérienne excessive. Cela inclut l’utilisation d’hypochlorémie due à l’utilisation chronique d’inhibiteurs de la pompe à protons (IPP) et la réduction des sécrétions pancréatrices causées par la pancréatatite chronique.
La dysmotilité est depuis longtemps documentée en tant que facteur de risque potentiel de croissance excessive bactérienne. Une étude récente (n x 150) visant à étudier le rôle de la dysmotilité et de l’utilisation d’IPP chez les patients présentant des troubles gastro-intestinaux persistants a démontré que les patients présentant une dysmotilité intestinale ont un risque accru de SIBO basé sur l’aspirate/culture duodénal (moins de 10 3 unités formant des colonies (UFC)/ml, odds ratio (OR) 3,6 ; P 0,0003) [6-. D’autres troubles gastro-intestinaux ont également été associés au développement de SIBO. Plus particulièrement, les maladies inflammatoires de l’intestin (MII), la dyspepsie, la pancréatite et les antécédents de colectomie ont tous été cités comme facteurs de risque potentiels de prolifération bactérienne. Dans une étude cas-témoins de 2018, les patients ayant subi une colectomie ont été diagnostiqués avec le SIBO à un pourcentage beaucoup plus élevé que ceux présentant des symptômes gastro-intestinaux de longue date sans colectomie antérieure (62 % vs 32 %, respectivement, P et 0,0005)7.
Une méta-analyse de 2019 menée dans le but de passer en revue la prévalence de SIBO chez les patients atteints de rectocolite hémorragique et de la maladie de Crohn a montré une corrélation directe entre les MICI et les SIBO [8. 11 études ont été incluses dans la méta-analyse avec 1 175 patients adultes atteints de MICI et 407 témoins. Le test respiratoire a été utilisé pour le diagnostic SIBO dans chacune des 11 études. La prévalence du SIBO chez les patients atteints de DI était de 22,3 % (IC à 95 % : 19,92 – 24,68). L’OR pour les patients atteints de DI chez les patients atteints de DI était de 9,51 (IC à 95 % : 3,39 – 26,68) et significative à la fois dans la rectocolite hémorragique (OR : 7,96 ; IC à 95 % : 1,66 – 38,35) et la maladie de Crohn (OR : 10,86 ; IC à 95 % : 2,76 ; 42,69). Les résultats de l’étude étayent l’idée que la MICI expose effectivement les patients à un risque plus élevé de prolifération bactérienne.
Le lien entre l’utilisation d’IPP et SIBO s’est avéré controversé dans le passé car les études initiales n’ont pas montré de corrélation directe entre leur utilisation et leur sensibilité accrue à la prolifération bactérienne. Cependant, des études ultérieures ont confirmé une association entre les IPP et le SIBO [9 Une étude rétrospective récente (n x 1 263 aspirats duodénaux) a montré que chez les patients ayant des résultats de culture positive, l’utilisation de l’IPP était beaucoup plus élevée par rapport à celles ayant des résultats de culture négatifs (52,6 % vs 30,2 %, respectivement).10 De plus, une méta-analyse de 2018 portant sur 19 études (N – 7055) a confirmé un risque plus élevé de croissance bactérienne bactérienne de petit intestinal à la suite d’une utilisation prolongée d’IPP (OR 1,7 ; IC à 95 % de 1,2 à 2,4) [9
Des anomalies structurelles impliquant la valve iléocécale ont également été citées comme facteur de risque potentiel pour SIBO. Le mécanisme proposé implique un reflux anormal ou inapproprié du microbiote colique dans la partie iléale de l’intestin grêle [11. Une étude visait à évaluer la relation entre la pression des valves iléocesiques et SIBO a conclu que les basses pressions de la vansialité iléocérocal prédisposent les patients à une prolifération bactérienne dans l’intestin grêle, avec des résultats positifs observés chez 15 des 23 sujets (65,2%), tels que déterminés par des tests d’haleine de lactulose (LBT) positifs [12 Les pressions de la jonction iléocétale étaient significativement plus élevées chez les sujets LBT négatifs que chez les sujets LBT-positifs (79,9% vs. 45,1 %, respectivement; p : 0,01). Malgré ces données, des études supplémentaires à grande échelle sont nécessaires pour élucider davantage la relation entre le dysfonctionnement de la valve iléocécale et le SIBO.
Tableau 1
Facteurs de risque de petite prolifération de bactéries intestinales
IPP: inhibiteur de la pompe à protons
|
Anomalies structurelles |
Motilité anormalité |
Anomalies biochimiques |
|
Rétractation de petits intestins |
Médicaments (opiacés, anticholinergiques) |
Pancréatite chronique |
|
Boucles intestinales aveugles |
Gastroparesis |
Hypochlorhydrie (par exemple, utilisation d’IPP, gastrite atrophique) |
|
Adhésions, restrictions |
Maladie du tissu conjonctif (par exemple, scléroderme) |
Variable d’immunodéficience de la variable |
|
Déficience des vannes isocénocales |
|
|
Ouvert dans une fenêtre séparée
Évaluation diagnostique
Il existe plusieurs modalités de test pour l’écran de SIBO; cependant, chacune présente ses propres limites et controverses. L’étalon-or actuel pour le diagnostic reste une culture quantitative de liquide aspiré de l’intestin grêle aspiré. Cependant, le coût élevé de la procédure, combiné à sa nature invasive, l’a rendue moins que idéale pour de nombreux patients. De plus, les limites de la procédure, y compris les concentrations bactériennes variables avec l’intestin grêle et la contamination possible par la flore oropharyngée, la rendent impraticable pour une utilisation clinique de routine. En outre, il est important de noter qu’un pourcentage élevé de bactéries colonisant l’intestin ne peut pas être cultivée et que la distribution inégale des bactéries avec l’intestin grêle qui empêche une quantification précise de la surcroissance bactérienne [13 – 15.
Les tests respiratoires sont des méthodes simples, non invasives et conviviaux pour diagnostiquer la prolifération bactérienne de la prolifération bactérienne. La nature pratique de la procédure et le faible coût en ont fait l’outil de diagnostic de référence dans la pratique clinique. Le rôle de diagnostic des tests respiratoires de l’hydrogène dépend en grande partie du type de substrat utilisé. Par exemple, les tests respiratoires de l’hydrogène au lactose sont utiles en cas de malabsorption des glucides, tandis que les tests d’hydrosolue et d’hydrosoluisation du glucose sont utiles pour diagnostiquer la surcroissance bactérienne. Chez les patients atteints de malabsorption des glucides, la flore intestinale colonique produit de l’hydrogène et du méthane à partir des substrats ingérés; chez les patients atteints de SIBO, les bactéries de l’intestin grêle produisent ces mêmes gaz. La majorité des gaz produits sont rapidement éliminés avec le passage flatus. Cependant, environ 20 % des gaz sont absorbés par le poumon puis expirés, ce qui permet une mesure quantitative lors des tests respiratoires. Contrairement à des études antérieures, où la mesure du niveau de méthane n’a pas augmenté le rendement des essais de l’haleine d’hydrogène, des données récentes suggèrent que le contrôle des niveaux de méthane augmente le rendement de diagnostic des tests respiratoires de l’hydrogène et devrait être utilisé à des fins de diagnostic [33, 16.
Il a été démontré que les tests de l’haleine d’hydrogène du glucose (GHBT) sont plus spécifiques mais moins sensibles, ce qui donne un taux plus élevé de faux-négatifs et un taux plus faible de faux positifs. La spécificité et la sensibilité du GHBT vont de 78 % – 97 % et 15,7 % – 62 %, respectivement. En revanche, les tests de lactulose sont plus sensibles mais moins spécifiques, avec une sensibilité rapportée de 31 % – 68 % et une spécificité de 65 à 9 97,9 %. Un consensus nord-américain récemment publié sur les tests de l’haleine d’hydrogène a caractérisé les valeurs seuils pour les tests respiratoires anormaux, une référence utile pour ceux qui ne savent pas comment interpréter les résultats diagnostiques3. Les directives indiquent qu’une augmentation de l’hydrogène de plus de 20 ppm (parties par million) après 90 min pendant les tests de glucose ou de respiration de lactulose doit être considérée comme un résultat positif. En outre, une augmentation des niveaux de méthane de plus de 10 ppm devrait être considérée comme du méthane. Le même rapport a énuméré des doses de consensus pour les tests respiratoires du glucose, du lactulose, du lactose et du fructose, respectivement, que 75, 10, 25 et 25 g.
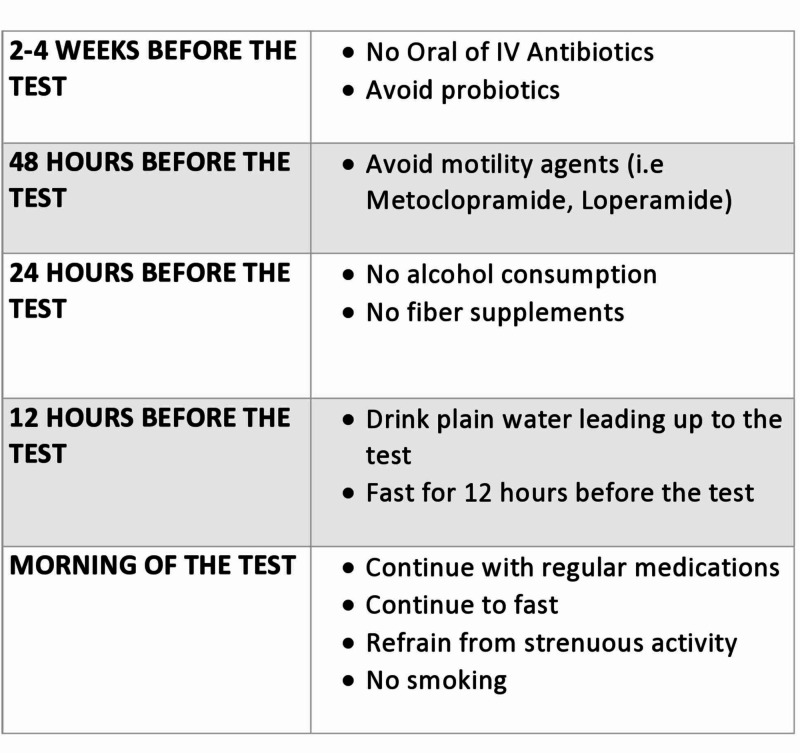
La préparation préalable aux essais joue un rôle essentiel dans l’obtention de données diagnostiques précises (Figure (Figure 1)1.1). Les recommandations recommandent d’arrêter les antibiotiques avant de procéder à des tests car leur utilisation a été associée à une modification de la composition de l’hydrogène et du méthane de l’haleine expirée [33, 17. Malgré l’absence de données claires, un écart de quatre semaines entre l’arrêt des antibiotiques et les tests de diagnostic est généralement recommandé [33, 18. Un faible niveau d’hydrogène à jeun est crucial pour une interprétation correcte des résultats des tests respiratoires, car les niveaux d’hydrogène sont directement affectés par la consommation de glucides complexes fermentesels [18 – 19. Par conséquent, il est maintenant recommandé aux patients d’éviter les glucides complexes et les produits laitiers le soir avant ou 24 heures avant de subir les tests. En outre, le tabagisme augmente les concentrations d’hydrogène expiré et devrait être évité le jour des essais, comme l’a suggéré le consensus nord-américain récemment publié sur les essais respiratoires à l’hydrogène et au méthane3.
Préparation de l’essai d’injection d’hale
IV : intraveineux
Les données de laboratoire de soutien peuvent être utilisées pour valider la suspicion de SIBO dans les cas où les modalités de diagnostic n’étaient pas concluantes. SIBO est classiquement associé à des carences nutritionnelles, avec des niveaux de vitamine B12 couramment affectés en raison de l’inhibition de l’absorption et/ou de l’absorption bactérienne compétitive. Bien qu’il existe certaines bactéries productrices de B12, la majorité des bactéries intestinales sont des consommateurs, ce qui entraîne une carence nutritionnelle. Les taux de folate sont fréquemment augmentés dans le SIBO car la vitamine est un sous-produit du métabolisme bactérien [20. Des carences en vitamines liposolubles (A, D, E, K) en raison de la malabsorption des graisses ont également été rapportées, présentant occasionnellement des implications cliniquement significatives, allant d’une diminution de la densité osseuse, de l’ostéoporose et de la neuropathie.21
Malgré la popularité des tests de l’haleine d’hydrogène, certaines limitations rendent cette méthode de diagnostic moins que parfaite. Le GHBT est souvent faussement négatif chez les personnes atteintes de SIBO distal, car le glucose est complètement réabsorbé dans l’intestin proximal et qu’il n’atteint souvent pas le site de prolifération bactérienne. De même, chez les patients en transit intestinal rapide, les tests respiratoires d’hydrogène produisent souvent des faux positifs en raison de l’administration précoce de substrats au côlon, augmentant le risque d’un résultat faussement positif.
Pour remédier aux lacunes des modalités d’essai actuellement disponibles, de nouvelles techniques de diagnostic sont actuellement à l’étude. Les approches indépendantes de la culture se sont révélées efficaces dans la découverte de nouvelles espèces bactériennes. Les techniques moléculaires récemment développées permettent d’identifier différentes espèces bactériennes sur la base des séquences de leurs gènes d’ARN ribosomas (16S) d’ARN ribosomal (16S), présents dans tous les microbes21. La métagénomique, définie comme l’analyse du matériel génétique, peut être utilisée pour reconstruire les génomes bactériens et étudier la diversité du microbiome intestinal et la dysbiose. D’abord décrit en 1998 par Handelsman et Rodon, la métagénomique vise à cataloguer les gènes par le séquençage aléatoire de tous les ADN extraits de l’échantillon [22-. De plus, la métagénomique permet d’identifier les voies microbiennes, les gènes de résistance aux antibiotiques et de déterminer les interactions et la co-évolution entre le microbiote et l’hôte.23
En tant qu’outil de diagnostic, la métagénomique reste au stade de la petite enfance. Par conséquent, la combinaison d’autres approches du microbiome, y compris les méthodes de culture, avec une étude de la métagénomique permet des résultats plus précis et convaincants. Des études récentes ont utilisé avec succès cette association pour identifier de nouvelles souches bactériennes. L’intestin humain n’est pas seulement habité par des bactéries, mais aussi par des eukaryotes et des virus. À ce jour, des études réussies ont été menées sur les virus eucaryote et en utilisant l’approche métagénomique, ce qui en fait un outil prometteur dans la future étude du microbiome intestinal humain23.
Thérapie conventionnelle
Antibiotiques systémiques
Compte tenu des limites des techniques de diagnostic actuelles, les cliniciens amorcent souvent la thérapie empirique en tant qu’outil de diagnostic chez ceux qui ont un niveau élevé de suspicion pour SIBO. Dans ce contexte, l’amélioration des symptômes à la suite d’un essai d’antibiotiques permettrait aux fournisseurs de faire le diagnostic. Cependant, cette stratégie en elle-même peut être problématique car elle expose les patients à des risques d’antibiothérapie, y compris le développement d’organismes résistants aux antibiotiques et d’infections (c’est-à-dire la colite Clostridium difficile).
Traditionnellement, les antibiotiques de référence pour le traitement de la SIBO étaient des tétracyclines, des fluoroquinolones et du co-trimoxazole. Cependant, la rifaximine est apparue comme l’agent préféré parmi les cliniciens pour la gestion de SIBO. La xiximine est un antibiotique non absorbable qui agit contre les bactéries aérobies et anaérobies à Gram positif et à Gram négatif. L’utilisation préférée de la rifaximine découle de sa réduction du profil de toxicité et de son utilité dans le syndrome du côlon irritable, un diagnostic avec un chevauchement clinique significatif avec SIBO. En outre, les données montrent que la rifaximine peut agir comme un agent « égoliptique » en préservant la flore colique tout en augmentant l’abondance relative des lactobacilles et des bifidobactéries dans l’intestin24. Le taux d’éradication du SIBO semble également être dose-dépendant. Une étude réalisée précédemment a rapporté un taux d’éradication dose-dépendante, où des doses plus élevées de rifaximine étaient associées à un taux d’éradication plus élevé [25. Dans une méta-analyse récente visant à étudier l’efficacité de la rifaximine dans la prolifération bactérienne, l’efficacité de la rifaximine dans l’éradication du SIBO était de 64 %, contre 41 % avec d’autres antibiotiques systémiques, y compris les tétracyclines et le métronidazole [26-. Une autre méta-analyse portant sur huit études a montré que l’efficacité de la rifaximine dans le taux de normalisation des tests respiratoires était de 49,5 %.27
Traitements alternatifs et nutritionnels
Diverses thérapies alternatives ont été proposées ces dernières années, dont beaucoup sont originaires de l’extérieur de la communauté médicale. Malgré l’absence de données à l’appui, une thérapie alternative peut représenter une option réaliste pour ceux qui ne répondent pas aux méthodes de traitement traditionnelles.
Probiotiques
Les probiotiques sont des micro-organismes vivants, qui peuvent atténuer les symptômes de SIBO lorsqu’ils sont administrés en quantités suffisantes. Les probiotiques agissent par de multiples mécanismes, y compris la modulation du microbiote intestinal, le maintien de l’intégrité de l’épithélium intestinal, la déréglementation des cytokines anti-inflammatoires et des facteurs de croissance, la production d’acides gras à chaîne courte et à chaîne ramifiée, ainsi que l’interaction avec l’axe cerveau-intestin en régulant les fonctions endocriniennes et neurologiques28. Une méta-analyse récente a suggéré que les probiotiques sont efficaces pour réduire la charge bactérienne chez les patients atteints de SIBO et atténuer leurs symptômes29. De plus, les probiotiques peuvent améliorer l’efficacité des antibiotiques, comme l’a démontré une étude récente dans le cadre d’une étude récente, chez des patients traités par la rifaximine en même temps que des probiotiques (Lactobacillus casei) ont présenté une amélioration plus importante de leurs symptômes avec la double thérapie que les antibiotiques seuls30. En revanche, une étude récente a également montré que les probiotiques peuvent provoquer des symptômes chez les patients atteints de SIBO, y compris le gaz, les ballonnements et la brouillard cérébrale.31 Dans l’étude, l’arrêt des probiotiques et une cure d’antibiotiques, ont résolu le brouillard cérébral tout en améliorant d’autres symptômes gastro-intestinaux (p x 0,005 chez 23/30 sujets (77%). Cela suggère que tous les probiotiques n’ont pas une efficacité égale et doivent être utilisés avec prudence chez les patients atteints de SIBO. Une étude de 2018 visait à évaluer comment les tests d’effet de l’utilisation récente de l’alcoolémie ont produit des résultats intéressants qui ont remis en question le rôle des probiotiques dans la gestion de SIBO (Mitten E, Goldin A: S660: L’utilisation récente de probiotiques est indépendamment associée à un test respiratoire positif au méthane pour la croissance bactérienne de petit intestinal. Présenté au cours annuel de l’American College of Gastroenterology Annual Scientific Mtg. and Postgraduate, du 5 au 10 octobre 2018, Philadelphie, PA). L’étude a montré que l’utilisation de probiotiques en un mois était indépendamment associée à une augmentation de la LBT positive au méthane chez les patients présentant des symptômes suspectés de SIBO. Les utilisateurs de probiotiques étaient significativement plus susceptibles d’avoir une LBT positive par rapport aux non-utilisateurs (93,6 % vs 65,7 %, p : 0,003). Plus précisément, les personnes ayant une utilisation récente de probiotiques étaient plus susceptibles d’avoir un LBT positif au méthane mais pas un LBT hydrogène positif. Ces résultats suggèrent que l’utilisation de probiotiques peut prédisposer à la prolifération des bactéries méthanogènes. L’utilisation de probiotiques peut potentiellement augmenter le risque de variante prédominante de la SIBO qui a été associée à des symptômes prédominants de constipation. L’absence d’un consensus clair concernant l’utilisation des probiotiques suggère que des études supplémentaires à grande échelle sont nécessaires pour mieux comprendre les effets des probiotiques sur le risque de SIBO.
Suppléments à base de plantes
Les suppléments à base de plantes commercialisés pour le soulagement de SIBO sont largement disponibles et sont devenus de plus en plus populaires, car beaucoup se détournent de la thérapie pharmacologique traditionnelle à la recherche de méthodes alternatives et moins coûteuses. Une étude récente a montré que la supplémentation en plantes peut être aussi efficace que la rifaximine, mesurée par un test respiratoire de suivi négatif. L’étude (n ‘ 251) s’est penchée sur les patients qui ont été testés positifs pour SIBO après un test respiratoire au lactulose (LBT). Dans l’étude, les sujets atteints de SIBO nouvellement diagnostiqué ont reçu deux choix de traitement; soit deux comprimés de 200 mg de rifaximine trois fois par jour (DIV) ou deux gélules deux fois par jour des préparations commerciales à base de plantes suivantes : Dysbiocide et FC CidalTM (Biotics Research Laboratories, Rosenberg, TX) ou Candibactin-AR et Candibactin-BR-(Metagenics, Inc. Les résultats ont montré que 17/36 sujets de supplémentation en plantes (46 %) avaient un suivi LBT négatif comparé à 23/67 (34 %) des utilisateurs de rifaximine. Le odds ratio d’avoir une TEP négative après avoir pris un traitement à base de plantes par rapport à la rifaximine était de 1,85 (IC : 0,77 – 4,41, P : 0,71 ; P : 0,71 ; .17) une fois ajustés pour les facteurs de risque de sexe, d’âge et de SIBO. La même étude a conclu que le traitement à base de plantes a une efficacité similaire à la triple antibiothérapie pour le traitement de secours SIBO pour les non-répondeurs à la rifaximine [32-. Cependant, il est important de noter que les données concernant les suppléments à base de plantes pour SIBO sont extrêmement limitées et les produits actuellement disponibles diffèrent considérablement en termes de composition et de qualité.
Régime alimentaire
La manipulation alimentaire peut être bénéfique pour soulager les symptômes de SIBO, y compris les ballonnements, les flatulences et les douleurs abdominales. Chez les patients atteints de SIBO, les bactéries intestinales fermentent les glucides, tels que le fructose, le lactose, les oligosaccharides, les disaccharides et les monosaccharides, entraînant la formation de gaz et les symptômes susmentionnés. Le régime pauvre en FODMAP (oligosaccharides, disaccharides, monosaccharides et polyols) est probablement le régime le plus connu pour SIBO; cependant, la plupart des données sur son efficacité sont basées sur le SCI, qui présente un chevauchement clinique significatif avec SIBO. La FODMAP représente une liste de sucres qui peuvent être fermentés dans l’intestin. Certaines bactéries qui habitent l’intestin grêle se développent en consommant des FODMAPS, par conséquent, la limitation de leur nombre prive les bactéries de la nutrition si nécessaire nécessaire à la croissance et à la prolifération. Bien qu’efficaces, les régimes FODMAP peuvent être complexes et difficiles à respecter sans conseils d’experts. La plupart des patients bénéficient d’une expertise professionnelle sur les différentes phases du régime, déclenchent l’identification, élimination lente des aliments et leur réintroduction dans l’alimentation quotidienne. En outre, les données montrent que les régimes riches en glucides complexes peuvent favoriser la prolifération de bactéries moins pathogènes par rapport aux régimes riches en graisses ou en protéines33. Les régimes vegan et végétariens riches en fibres se sont avérés efficaces pour beaucoup avec les symptômes SIBO. Ces régimes augmentent la production d’acides gras à chaîne courte, tout en inhibant simultanément des bactéries potentiellement invasives, telles que Escherichia coli et d’autres membres de l’espèce Enterobacteriaceae [34.
Une étude de 2019 visant à analyser les schémas nutritionnels chez les patients atteints de SIBO résistant au traitement a montré que les sujets résistants au traitement avaient une consommation plus élevée de sarrasin par rapport aux sujets sensibles au traitement (0,41 x 0,47 vs 0,14 x 0,35, p x 0,001), la viande de volaille (0,80 x 0,64 vs 0,54 x 0,62, p x 0,01), le millet (0,036 x 0,11 vs 0,00,00,01) [35. Le régime alimentaire des patients atteints de SIBO résistant au traitement était également significativement plus bas en mono- et disaccharides (75,2 x 32,7 vs 95,5 x 41,5 g/jour ; p : 0,015). Ces données peuvent être utilisées pour orienter les plans diététiques pour l’entretien du traitement par SIBO et la prévention de la rechute des symptômes.
Un régime élémentaire composé de micronutriments prédigérés a également été suggéré comme option pour soulager potentiellement les symptômes de SIBO. Le bénéfice proposé du régime alimentaire provient de la quantité élevée de micronutriments prédigés qui sont principalement absorbés dans l’intestin de l’intestin proximal, limitant ainsi l’apport de nutriments à la partie distale de l’intestin grêle. Une étude rétrospective a examiné le bénéfice potentiel du régime élémentaire chez les patients atteints de SIBO. Dans l’étude, les patients ont été traités par un régime élémentaire pendant une période de 14 jours. Le taux de réponse symptomatique global dans cette cohorte était de 85 %, comme l’indique la normalisation des tests respiratoires [36 Malgré des données prometteuses, un tel régime n’est peut-être pas durable pour beaucoup en raison du coût élevé, en particulier pour ceux qui n’ont pas de garantie d’assurance ou de garantie d’assurance. Bien que la modification du régime alimentaire représente une manœuvre thérapeutique à court terme, l’idée qu’elle peut traiter la croissance bactérienne à long terme doit être évitée, car souvent les facteurs de risque sous-jacents pour SIBO subsistent.
Éche et insuffisance du traitement
Malgré l’efficacité avérée des antibiotiques pour soulager les symptômes, environ 40 % des patients présentant des symptômes pseudo-sympotiques SIBO peuvent ne pas présenter la résolution de leurs symptômes avec une antibiothérapie. Les personnes qui échouent au traitement standard doivent faire l’objet d’une évaluation pour d’autres diagnostics de chevauchement (Figure2) (Figure2).2 Parmi ceux-ci, la carence en disaccharide ou l’intolérance alimentaire sont les conditions les plus fréquemment diagnostiquées dans le cadre des consultations externes. Les patients présentant une double maladie, telles que le SIBO et l’intolérance au lactose, peuvent ne présenter qu’un soulagement partiel de leurs symptômes par une antibiothérapie et nécessiteront des régimes sans lactose à long terme. En tant que tel, une évaluation approfondie des symptômes et des tests de diagnostic appropriés sont nécessaires pour exclure d’autres conditions chez celles présentant une réponse sous-optimale à une antibiothérapie.
Algorithme de gestion SIBO
FODSMAPS: oligosaccharides, disaccharides, monosaccharides et polyols fermentesséns; SIBO: faible intestinal bactérien
Conclusions
SIBO reste un diagnostic largement répandu dans la pratique de la gastro-entérologie de la référence tertiaire. Bien que des progrès importants aient été accomplis dans notre compréhension de l’état, les efforts visant à démêler ce diagnostic complexe restent entravés par les limites des outils de diagnostic actuellement disponibles. Bien qu’il n’existe pas de test de diagnostic parfait pour SIBO, les tests respiratoires actuellement disponibles se sont avérés être une méthode sûre et préférée dans la pratique clinique. L’absence de critères clairs et d’outils de diagnostic, il est plus difficile de prouver le diagnostic de SIBO lorsqu’il est suspecté. Cela pourrait bientôt changer, cependant, car l’application des techniques moléculaires à l’étude du microbiome intestinal du petit intestinal, associée à des techniques d’échantillonnage innovantes, pourrait bientôt permettre aux cliniciens de définir véritablement le spectre de SIBO. Des études supplémentaires sont nécessaires pour caractériser davantage les mécanismes physiopathologiques qui contribuent à l’élaboration de SIBO et pour étudier un traitement optimal pour cette population de patients difficile. Alors que SIBO continue d’être un diagnostic controversé, à l’ère de la recherche en plein essor sur le microbiome, les gastro-entérologues et d’autres cliniciens ne manqueront pas de mieux connaître le SIBO dans la population générale, ce qui leur permettra de fournir un traitement plus efficace.
Notes
Le contenu publié dans Cureus est le résultat d’expériences cliniques et/ou de recherches menées par des individus ou des organisations indépendants. Cureus n’est pas responsable de l’exactitude ou de la fiabilité scientifique des données ou des conclusions publiées dans le présent document. Tous les contenus publiés dans Cureus sont destinés uniquement à l’éducation, à la recherche et à des fins de référence. En outre, les articles publiés dans Cureus ne devraient pas être considérés comme un substitut approprié à l’avis d’un professionnel de santé qualifié. Ne pas ignorer ou éviter les avis médicaux professionnels en raison du contenu publié au sein de Cureus.